2024年9月29日,上海复旦大学林玉丽教授团队在《Journal of Hepatology》发表'FABP5+ lipid-loaded macrophages process tumour-derived unsaturated fatty acid signal to suppress T-cell antitumour immunity'研究论文,研究聚焦肝细胞癌(HCC)中肿瘤相关巨噬细胞(TAMs)的代谢重编程与免疫抑制机制,揭示了脂肪酸结合蛋白 5(FABP5)作为治疗靶点的潜力。
1 研究背景:
肝癌(HCC)作为全球高发的恶性肿瘤,免疫治疗虽为部分患者带来希望,但耐药问题仍困扰临床。研究揭示了肝癌免疫逃逸的关键新机制 ——FABP5+脂质负载肿瘤相关巨噬细胞(TAMs)通过调控脂肪酸代谢,强效抑制T细胞抗肿瘤活性,为肝癌治疗提供了全新靶点。
2 研究亮点:
研究团队通过单细胞 RNA 测序,在小鼠和人类肝癌组织中发现了一类特殊的巨噬细胞亚群 ——FABP5+脂质负载TAMs。与其他巨噬细胞相比,这类细胞具有两大鲜明特征:
1.脂质代谢异常活跃:高表达脂肪酸结合蛋白(FABP4/5)、CD36 等脂质转运相关分子,胞内脂质大量堆积;
2.免疫抑制功能极强:过量表达 PD-L1、PD-L2、半乳糖凝集素(Gal-1/3/9)等免疫检查点分子,直接抑制T细胞增殖和细胞因子分泌。
更关键的是,临床数据显示,肝癌患者肿瘤组织中 FABP5+TAMs数量越多,预后越差,且与T细胞耗竭特征高度相关 —— 这意味着这类细胞是预测患者生存和免疫治疗效果的潜在生物标志物。
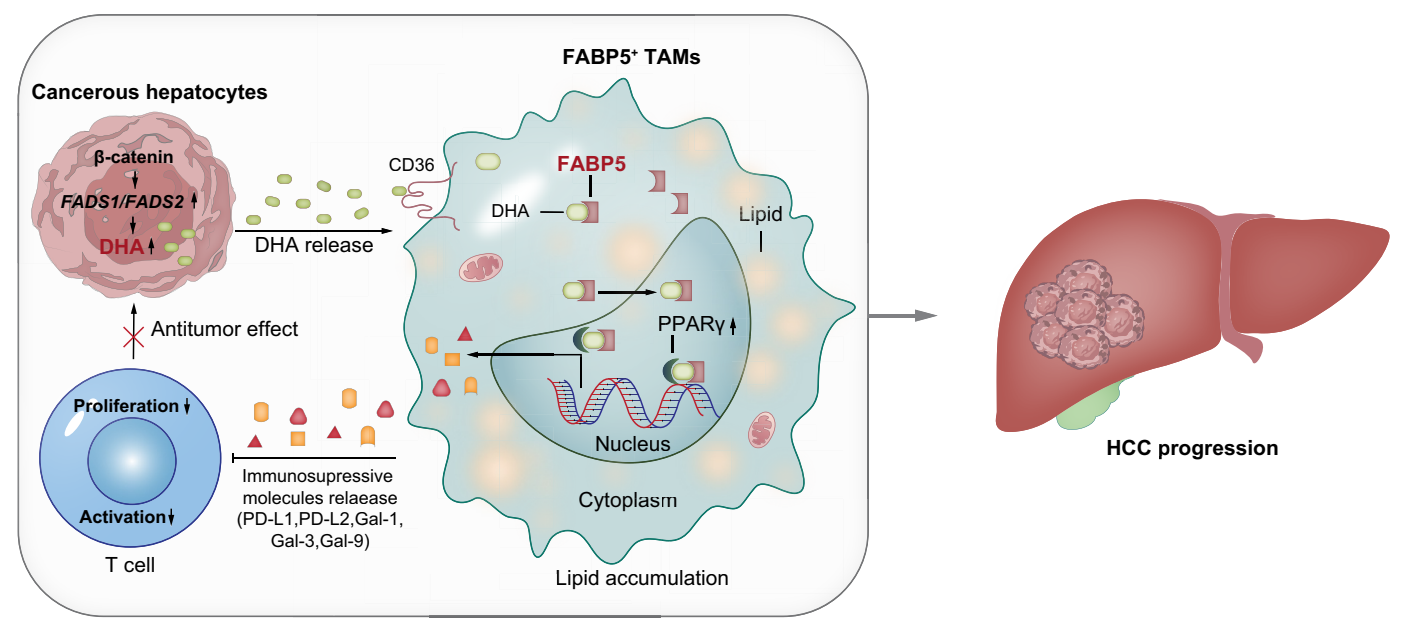
3 总结:
研究通过 MYC/β-catenin 驱动的肝癌模型及单细胞 RNA 测序,发现随肿瘤进展,TAMs 被重编程为 FABP5 + 脂质负载亚群。该亚群高表达脂质代谢基因(如 CD36、PPARγ)和免疫抑制分子(如 PD-L1、Gal-1/9),通过 BODIPY 493/503 染色证实其脂质积累特征,CellChat 分析显示其与耗竭型 T 细胞、调节性 T 细胞存在强互作。
机制上,肿瘤细胞通过 FASN、FADS1/2 合成不饱和脂肪酸(如 DHA、油酸),经 CD36 被 TAMs 摄取。FABP5 将 DHA 转运至细胞核,激活 PPARγ 转录,进而上调免疫抑制分子表达,抑制 T 细胞增殖及 IFN-γ 分泌。敲除巨噬细胞 FABP5 或 PPARγ 可逆转该免疫抑制表型,抑制肿瘤生长。临床数据显示,HCC 患者肿瘤组织中 FABP5+ TAMs 比例与 T 细胞耗竭、不良预后正相关。体内实验证实,靶向 FABP5 可增强抗 PD-1 治疗效果,使肿瘤消退率从 18.7% 提升至 52%,且在脂肪肝相关肝癌模型中同样有效。
研究首次阐明 FABP5-PPARγ 通路介导的脂质代谢 —— 免疫抑制串扰,为肝癌治疗提供新思路,提示靶向FABP5或肿瘤脂肪酸合成可改善免疫治疗耐药性。
站外链接:吕凌课题组(公众号):https://mp.weixin.qq.com/s/NmWnuiC7MWnpoz7hF5JRXA

