2025年10月14日,美国匹兹堡大学Greg M. Delgoffe教授团队联合卡内基梅隆大学、堪萨斯大学医学中心等机构,在《Immunity》发表题为《Oxidative-stress-induced telomere instability drives T cell dysfunction in cancer》的研究论文。该研究首次证实:肿瘤微环境中,线粒体来源的活性氧(ROS)会特异性损伤T细胞端粒而非导致端粒缩短,引发端粒脆性增加和 DNA 损伤,最终驱动T细胞功能异常;而通过端粒靶向抗氧化可修复端粒损伤,显著改善治疗性T细胞的抗肿瘤效果,为癌症细胞治疗提供了全新靶点。
1 研究背景:
肿瘤浸润淋巴细胞(TIL)的功能状态是决定抗肿瘤免疫效果和免疫治疗响应的核心因素。在TME中,持续抗原刺激、缺氧等代谢屏障会导致T细胞逐渐失去多功能性,最终进入 “终末耗竭” 状态 —— 表现为 PD-1、Tim3等共抑制分子高表达,且失去自我更新转录因子 TCF7 的表达。
端粒是染色体末端的保护结构,其功能异常会引发细胞周期停滞、凋亡或衰老。已知氧化应激可直接损伤 DNA,而端粒因富含 “TTAGGG” 重复序列,成为基因组中对 ROS 最敏感的区域之一。此前研究已发现,线粒体功能异常导致的 ROS 累积会加速 T 细胞终末分化,但 TME 中 ROS 如何通过端粒影响 T 细胞功能,仍未得知。
传统诱导 ROS 的方法缺乏特异性,本研究通过 “化学光遗传学系统”解决了这一问题,该系统可在 T 细胞特定部位精准产生单线态氧,从而明确端粒损伤与 T 细胞功能的因果关系。
2 研究亮点:
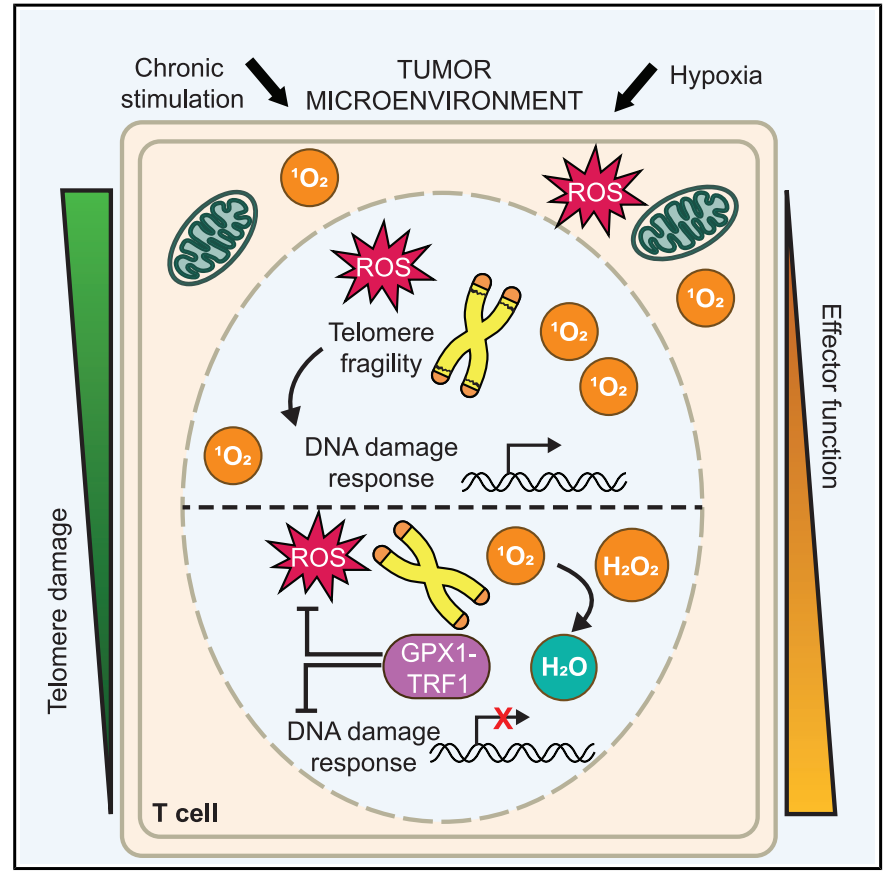
①.建立化学光遗传学系统,可在T细胞线粒体或端粒局部精准产生ROS,解决了传统ROS诱导方法的非特异性问题;
②.首次发现 端粒损伤(而非缩短)”是T细胞功能异常的关键:
③.证实小鼠和人 TIL 中均存在端粒损伤累积,且与 T 细胞耗竭程度正相关,为临床转化提供依据;
④.开发GPX1-TRF1端粒靶向抗氧化策略,显著改善治疗性 T 细胞的抗肿瘤效果,为细胞治疗提供新方案。
⑤.直接的临床转化与治疗验证:证明靶向TNFRSF14可以与抗PD-1疗法产生强大的协同效应,显著抑制肿瘤生长。TNFSF14-TNFRSF14信号轴有望成为预测SLD-HCC免疫治疗疗效的生物标志物和新的药物靶点。
3 总结:
本研究通过精准定位ROS和端粒靶向干预,首次完整揭示了TME中T细胞功能异常的核心机制:线粒体 ROS→端粒损伤→DNA 损伤响应→T 细胞耗竭 / 衰老;且在小鼠和人 TIL 中均证实端粒损伤与T细胞功能的相关性;最终通过端粒靶向抗氧化验证了这一机制的治疗价值。
局限性
①.物种差异:小鼠TIL端粒无缩短,而人TIL端粒略有缩短,需进一步验证端粒损伤和缩短在人T细胞中的协同作用; ②.机制深度:未完全明确端粒损伤与线粒体功能的交叉调控,需结合转录组和代谢组深入分析; ③.模型局限:缺乏T细胞特异性端粒基因敲除模型,无法完全排除其他通路的干扰; ④.临床转化:需在更大样本的人TIL中验证 GPX1-TRF1 的效果。
站外链接:吕凌课题组(公众号):https://mp.weixin.qq.com/s/-KHFnu5hpmpPgFCSZ7r7oA

